
Una compañía de British Columbia llamada bioLytical™ Laboratories Inc., recibió la aprobación de la FDA para su examen rápido del VIH, el cual tiene una sensibilidad y especificidad mínima de un 99,8% y 99,5% respectivamente. De acuerdo con la nota de prensa, la FDA aprobó la prueba rápida INSTI™ del VIH, para la detección de los anticuerpos al VIH-1 en la sangre completa, en los pinchazos al dedo o en las muestras de plasma. La compañía todavía espera la aprobación regulatoria para la detección del VIH-2.
.
Más sobre la prueba:
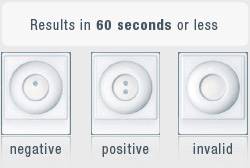 INSTI incluye la construcción de un antígeno único compuesto de proteínas recombinantes para el VIH-1 (gp-41) y VIH-2 (gp-36). “Estos antígenos únicos aseguran que la prueba se constituya en una adición sumamente importante a cualquier algoritmo de pruebas rápidas,” dijo Rick Galli, oficial técnico en jefe de bioLytical. Como pasa con todas las pruebas rápidas para el VIH, los resultados positivos son considerados preliminares y deben ser confirmados antes de establecer un diagnóstico de infección por el VIH.
INSTI incluye la construcción de un antígeno único compuesto de proteínas recombinantes para el VIH-1 (gp-41) y VIH-2 (gp-36). “Estos antígenos únicos aseguran que la prueba se constituya en una adición sumamente importante a cualquier algoritmo de pruebas rápidas,” dijo Rick Galli, oficial técnico en jefe de bioLytical. Como pasa con todas las pruebas rápidas para el VIH, los resultados positivos son considerados preliminares y deben ser confirmados antes de establecer un diagnóstico de infección por el VIH.
INSTI también incluye un control mejorado y único del procedimiento, puesto que utiliza una muestra verdadera de igG humano. El examen solo reacciona cuando se agrega la cantidad correcta de sangre humana, reduciendo la posibilidad de error por parte del usuario, lo cual podría conducir a resultados equivocados. La prueba es sumamente estable y no requiere de refrigeración ni de almacenaje especial.



